Оксидативный стресс
Печень — самый большой паренхиматозный орган человека, и для его многочисленных метаболических функций необходимо большое количество энергии. Большую часть энергии клетки получают из молекул АТФ, образующихся при переходе кислорода в воду. Этот процесс называется окислительным фосфорилированием и происходит в митохондриях. В результате образуется АТФ и вода, около 5% кислорода превращается в супероксидный анион, и его метаболиты, их совокупность называют активными формами кислорода. Как побочные продукты окисления препаратов под действием ферментов цитохрома Р450 активные формы кислорода могут образовываться и за пределами митохондрий. Активные формы кислорода могут быть опасны для клеток, поскольку могут реагировать с белками, ДНК или липидами, вызывать повреждение или гибель клетки. Например, активные формы кислорода могут запускать перекисное окисление липидов. В этой цепной реакции ненасыщенные жирные кислоты мембраны разрушаются до небольших летучих молекул, которые можно найти в выдыхаемом воздухе.
Как правило, активные формы кислорода не накапливаются в гепатоцитах благодаря множеству механизмов инактивации. Кроме того, когда активные формы кислорода начинают накапливаться в клетке, развивается координированный «антиоксидантный ответ». Он заключается в активации ядерного фактора R2, который опосредует транскрипцию определенных генов, включая образование трансфераз, кодирующих синтез глутатиома, а также уридиндифосфат глюкуронилтрансферазы. Термин «оксидатианый стресс» применяют в том случае, когда количество активных форм кислорода превышает защитные возможности клетки, что приводит к накоплению активных форм кислорода и окислительному повреждению клетки. Помимо некроза, оксидативный стресс может вызывать запрограммированную гибель клетки.
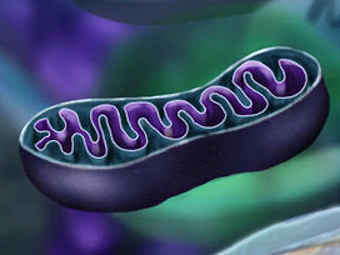
Роль митохондрий как мишени для токсических метаболитов
Митохондрии — главный источник клеточной энергии нужны затраты энергии, поэтому необходимы работающие митохондрии.
Теоретически работа митохондрий может остановиться из-за образования ковалентных связей между токсическими метаболитами и ключевыми белками, участвующими в работе митохондрий, или из-за повреждения митохондриальной ДНК. Большинство митохондриальных белков кодируется генами, расположенными в клеточном ядре, однако некоторые жизненно важные белки, участвующие в окислительном фосфорилировании, кодируются митохондриальной ДНК. В митохондриях отмечают относительный дефицит ферментов, отвечающих за репарацию ДНК, следовательно, мутации ДНК, спровоцированные токсическими метаболитами, могут оказывать большее влияние на митохондрии, чем на другие клеточные органеллы. Например, считают, что некоторые противовирусные препараты моуг вызывать печеночную недостаточность, так как вызывают мутации митохондриальной ДНК.
Функции митохондрий могут нарушаться при истощении запасов митохондриального глутатиона. Митохондрии особенно чувствительны к истощению глутатиона, так как не синтезируют его, он должен поступать из цитоплазмы. Помимо этого, в митохондриях не хватает каталаз, поэтому инактивация активных форм кислорода происходит под действием глутатионпероксидазы. Активность глутатионпероксидазы напрямую зависит от концентрации глутатиона в митохондриях, если концентрация глутатиона падает ниже 2-3 ммоль, активность фермента быстро снижается. При истощении митохондриального глутатиона в митохондриях более чем на 90% значительно уменьшается безопасная инактивация активных форм кислорода. Так как активные формы кислорода в митохондриях образуются постоянно, даже в полностью здоровых гепатоцитах, для инициации оксидативного стресса может быть достаточно истощения запасов глутатиона. Так как митохондрии — это основная мишень для N-ацетил-р-бензохинонимина, а он с готовностью связывает глутатион, предполагают, что истощение запасов глутатиона в митохондриях — это один их механизмов гепатотоксичности парацетамола.
Митохондрии играют центральную роль в апоптозе клетки. Это может подтверждать гипотезу, что митохондрии произошли из бактерий: с появлением кислородной атмосферы они попали в клетку эукариот и стали ее частью. Рудиментарные механизмы окислительного фосфорилирования бактерий позволили клеткам эукариот выжить в токсической окружающей среде. В некоторых случаях бактериям также была выгодна стабильная среда клетки-хозяина. Появилась теория, что у бактерий сохранилась или появилась способность вызывать гибель клетки и, таким образом, далее они могли «действовать в одиночку». Согласно этой теории, у бактерий, попавших в клетку и ставших постоянной ее составляющей, сохраняется способность вызывать гибель клеток.
Механизмы, посредством которых митохондрии запускают гибель клетки, довольно хорошо изучены. Предполагают, что первоначально происходит деполяризация внутренней мембраны митохондрий, т.е. смена проницаемости митохондриальной мембраны, она приводит к открытию пор. Нарушение проницаемости митохондрий приводит к потере протонного градиента, необходимого для образования АТФ. Если изменения произошли во всех митохондриях, то клетка погибает. Однако непосредственный эффект нарушения проницаемости митохондриальной мембраны и открытых пор — это набухание митохондрии и возможный разрыв ее наружной мембраны. Когда митохондрия разрушается, высвобождается цитохром С.






























Leave a Response