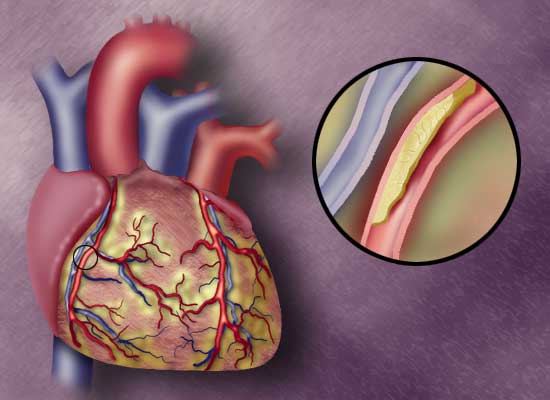
Тканевой фактор и атеросклеротическая бляшка
Как указано выше, окклюзивные тромбы коронарных артерий рассматриваются как последствие разрыва бляшки и являются ведущей причиной смерти в западных странах. Вследствие этого и поскольку наличие ТФ в бляшках необходимо для тромбоза, наличие этого протеина в бляшке оценивалось во многих исследованиях.
Еще в 1972 году ТФ был выявлен в бляшках методом иммуноокрашивания, хотя антитело, несомненно, было полиспецифическим. Последующие эксперименты с антителами, выработанными против чистого ТФ, подтвердили эти находки, так же как и результаты, полученные при использовании моноклональных антител и меченного гаптеном фактора Vila — специфического теста на ТФ. Поскольку иммуноокрашивание отражает лишь локализацию антигена, а связывание Vila с ТФ — локализацию мест связывания наТФ, отсюда следует, что ни одна из этих методик не выявляет активности ТФ в бляшке. Сообщалось о непосредственной ферментной оценке ТФ, полученного из бляшки, при этом большинство образцов были активными. Однако, активность была низкой, и не было уверенности в том, что образцы содержали лишь бляшку. Таким образом, значимость указанных полученных данных остается под вопросом. Чтобы однозначно продемонстрировать наличие активного ТФ в бляшке, нужен ферментный гистохимический анализ на наличие ТФ, о котором, однако, сообщений не было.
Циркулирующий тканевой фактор: тромбогенные разновидности
В недавних экспериментах показано, что нативная, нормальная кровь человека формирует зависимые от ТФ тромбы на покрытой коллагеном стеклянной поверхности, помещенной в камеру с ламинарным кровотоком. Тот факт, что эти тромбы содержат фибрин, свидетельствует о том, что отложенный в тромбе ТФ является биохимически активным. Кроме того, включение фактора Vila с угнетением точки активности практически устраняло формирование как фибрина, так и тромба на коллагеновой поверхности. Эти данные опровергают многие опубликованные положения, включая наше собственное, что циркулирующий ТФ не играет никакой роли. Кроме того, эти эксперименты позволяют сделать предположение, что экспозиции коллагена в кровеносных сосудах может быть достаточно, чтобы инициировать формирование тромба. В то же время, вполне вероятно, что ТФ стенки сосуда инициирует формирование тромба, тогда как циркулирующий ТФ может быть ответственным за его распространение.
Очевидно, находящийся в крови ТФ может инициировать тромбоз ex vivo с помощью следующего механизма: вначале происходит связывание тромбоцитов с коллагеном; после этого нейтрофилы и моноциты связываются с тромбоцитами. Лейкоциты, содержащие ТФ, очевидно, откладывают содержащие ТФ мембранозные структуры на тромбоциты, делая их высоко тромбогенными. Эти эксперименты были задуманы для того, чтобы имитировать тромбоз in vivo в том смысле, что создавался ламинарный кровоток со скоростью, соответствующей стрессу растяжения артериол. Мы можем предположить, что зона стресса растяжения, возникающая в незначительно стенозированных коронарных артериях, благоприятствует доставке лейкоцитов к рождающемуся тромбу и их фрагментации in situ. Таким образом, с увеличением тромба вокруг тромбоцитов накапливаются содержащие ТФ везикулы и мембранозные структуры, которые могут инициировать коагуляцию и способствовать распространению тромба.
Кодирование тканевого фактора клеточной поверхности: какие разновидности являются биологически активными?
Тот факт, что переносимый кровью ТФ проявляет активность в экспериментальном тромбогенезе, позволяет предположить, что существует механизм контроля его активности в клетках крови. Возможно, в основе механизма лежит кодирование in vivo ТФ клеточной поверхности. То есть, хотя ТФ клеточной поверхности способен связывать фактор Vila и специфические антитела, однако является каталитически неактивным. Феномен кодирования, или спячки на поверхности клетки, был предложен много лет назад, впоследствии изучен и доказан с использованием современных методик. Было сделано предположение, что на клеточной поверхности ТФ существует в виде неактивных димеров, и для проявления прокоагулянтной активности должен быть превращен в мономеры. Количественные исследования, в которых использовались культуры клеток, показали, что большинство поверхностного ТФ закодировано.
Одно из предположений, которое сложно исследовать, состоит в том, что in vivo ТФ поверхности клеток является неактивным. Если это так, то возникает вопрос о состоянии активных разновидностей. Внеклеточный ТФ был отмечен в адвентиции артерий и бляшках и может представлять собой активный пул. Есть достаточно доказательств того, что для оптимальной активности ТФ требуется экспозиция к кислым фосфатидам. Предполагают, что в норме эти молекулы находятся во внутренних слоях плазматических мембран, что делает эти мембраны более или менее неактивными. Однако внеклеточный ТФ присутствует на мембранных фрагментах и везикулах, которые не имеют достаточной энергии, чтобы поддерживать асимметрию фосфолипидов. Поэтому можно ожидать, что кислые фосфатиды имеют случайное распределение, а в результате этого внеклеточный ТФ, вероятно, является прокоагулянтом.




























Leave a Response