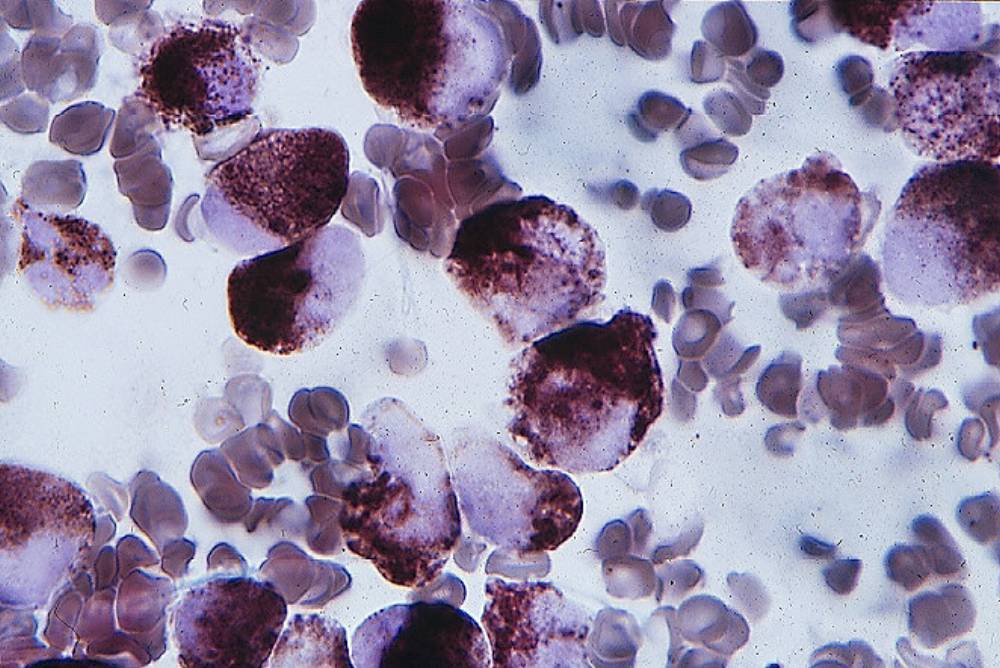
Недостаточность миелопероксидазы
Миелопероксидаза — фермент, содержащий гем. Фермент локализован в цитоплазме. Ядерная миелопероксидаза защищает ДНК ядра от токсических радикалов кислорода. Слабость антимикробной защиты при дефиците фермента проявляется в сочетании ИДС с другими заболеваниями. Отмечена повышенная чувствительность ббдьйых к грибковой инфекции кандида. Во всяком случае, данный дефект снижает сопротивляемость организма к инфекции. Этому способствует компенсаторное повышение окислительного метаболизма грайулоцитов, превосходящее. нормальные значения этого показателя. Дефект миелопероксидазы наследуется по аутосомно-рецессивному типу и, по-видимому, это самая частая аномалия фагоцитирующих клеток. Частота этого дефекта около 1:2000.
М. Yaipada и соавт. изолировали кДНК для гена миелопе роксцдазы. Ген локализован на хромосоме 17q22 — q24 в тесной близости с кластером генов гормона роета. Предполагается, что ядерная миелопероксидаза защищает ДНК отвоздействия токсических радикалов, кислорода й перекйси водорода.
Кандидоз при недостаточности миелопероксидазы прогностически не фатален, но нередко отличается хроническим течением.
Недостаточность, глютатионпероксидазы ведет к ограничению элиминаций перекиси водорода и синтеза окисленной формы глютатиона GSSG-субстрата глютатионредуктазы. Это вызывает нарушения в системе метаболизма Глютатиона, несомненно, ограничивающие функции фагоцитов. Однако отсутствие каких-либо клинических проявлений у лиц с этим дефектом свидетельствует о его компенсированном характере. По-видимому, дефект выявляется лишь при функциональных нагрузках на фагоцитарную систему, когда требуется преобразование избытка перекиси водорода.
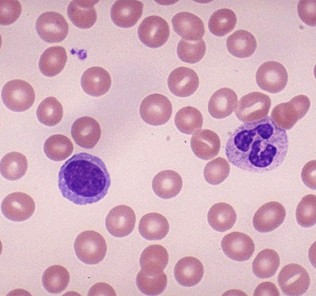
Недостаточность глюкозо-6-фосфатдегидрогенаЗы лейкоцитов. Активация гексозОмонофосфахного шунта является обязательным процессом при фаГсЩитрзе. Ключевым ферментом служит Г-6-ФД. Однако ее недостаточность в лейкоцитах встречается реже, чем в эритроцитах; когда она проявляется симптомокбМплексом гемолитической ацемии. ГраНулодиты больных с дефицитом Г-6-ФД не имеют морфологических особенностей. Процессы.поглощения; дегрануляции и высвобождения лизосомных ферментов протекают без отклонений от нормы. Однако внутриклеточный каталазопозитивный киллинг бактерий снижен, тогда как уничтожение каталазонегативных микробов не нарушено. Это указывает на ограничение продукции перекиси водорода.
Фагоциты способны компенсировать недостаточность Г-6-ФД. Таким образом, как и дефицит миелопероксидазы, недостаточность Г-6-ФД можеТ быть отнесенд к малым аномалиям фагоцитарнои системы.
Хронический кйндидоз. У больных хроническим кандидозрм обнаружена недостаточность лизосомного фермента алЬфа-маннозидазы, в связи с чем, манноза не подвергалась гидролитическому расщеплению.
Данный моносахарид входит в состав стенки грибковых и дрожжевых клеток. Если эти данные будут подтверждены, то наследственный генерализованный кандидрз нужно будет отнести к ферментопатиям фагоцитирующих клеток. Дефицит Миелопероксидазы предрасполагает к кандидозу.


























Leave a Response